Axis
Centre Medical
30 avenue Général Lartigue - 1200 Bruxelles
Plasma Riche en Plaquettes
1.Introduction
Le Plasma Riche en Plaquettes (PRP) est défini comme une suspension de plaquettes dans du plasma dont la concentration plaquettaire est supérieure à la concentration du prélèvement sanguin de départ. En effet n’est pas considéré « PRP » un plasma dont les plaquettes sont inférieures à 200% par rapport au sang d’origine (en général entre 250 et 600%)
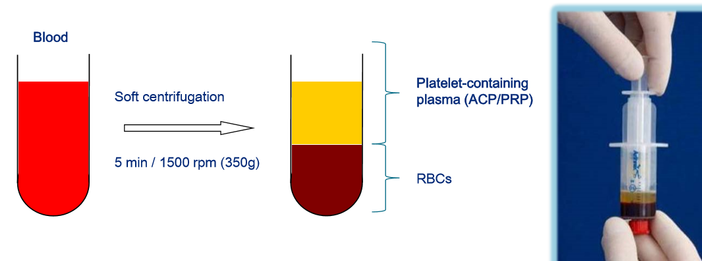
Celui-ci est obtenu à partir du sang du patient lui-même, après prélèvement et processus de centrifugation. C’est ainsi que les globules rouges et globules blancs sont séparés du plasma, des plaquettes et de l’environnement de celles-ci, qui est constitué de facteurs de croissance et des cytokines inflammatoires.
L’intérêt du PRP réside donc dans la capacité des plaquettes et de cet environnement à améliorer et accélérer la cicatrisation du tissu. Son avantage majeur provient de son caractère autologue (provenant du patient lui-même), ce qui permet d’éviter la contamination d’agents infectieux graves. Cette caractéristique lui confère également d’excellentes propriétés de biocompatibilité et biodégradabilité.
2.Histoire et champs d’application
En 1970, la colle de fibrine, précurseur du PRP, est utilisée pour ses propriétés d’adhésion physique et chimique dans les tissus. Elle est alors appliquée chez l’animal. Son utilisation chez l’humain est cependant interdite en 1970 à cause de son risque important de contamination. La première application médicale du PRP date de 1987, lors d’une intervention cardiaque. Il a été alors utilisé afin d’éviter les transfusions sanguines chez les patients.
L’utilisation du PRP devient de plus en plus courante à partir des années 1990. Dans les années 2000 des firmes pharmaceutiques commencent à s’y intéresser et on voit apparaître quelques études cliniques avec les premiers dispositifs médicaux labellisés « CE » autour de 2007.
A l’heure actuelle, cette thérapeutique est utilisée dans différents domaines de la médecine. En orthopédie et médecine sportive elle améliore la guérison de certaines lésions musculaires, tendineuses et cartilagineuses. Le PRP trouve également une place en médecine esthétique car il favorise la régénération cellulaire et améliore l’élasticité de la peau, ainsi que la qualité du cheveu. Il est donc utilisé pour atténuer certaines rides et augmenter la masse capillaire.
En médecine réparatrice, il est utilisé chez les grands brûlés pour améliorer et accélérer la réparation des tissus lésés. Enfin, le PRP permet en chirurgie maxillo-faciale de renforcer l’os de mauvaise qualité dans lequel sont placés des implants, améliore les greffes de palais et de gencive et diminue les saignements.
3.Mécanisme d’action du PRP
Le plasma riche en plaquette est une suspension de plaquettes autologues obtenue par processus de centrifugation. L’activation des plaquettes est initiée dans le tube puis, lors de l’injection, se prolonge dans le tissu au contact de celui-ci. Les plaquettes s’accrochent entre elles (agrégation plaquettaire) et libèrent leurs granules alpha contenant des cytokines inflammatoires et des facteurs de croissance. Les cytokines attirent un grand nombre de cellules vers elles par vasodilatation et les facteurs de croissance peuvent alors avoir une influence spécifique sur ces cellules. Ce mécanisme reproduit une étape physiologique de colonisation et remodelage tissulaire qui est présent normalement dans les premiers temps de cicatrisation.
L’intérêt du plasma riche en plaquette réside dans sa concentration majorée en plaquettes (de x2.2 jusqu’à x6.6) et sa plus faible concentration en globules blancs et rouges. En effet la lyse des globules rouges entraine la libération de radicaux libres. La présence des globules blancs quant à elle, favorise la présence des facteurs pro-inflammatoires. Ces deux phénomènes sont nuisibles pour la matrice tissulaire. A l’heure actuelle, il est donc fait une différence entre le L-PRP (leucocyte et PRP) et P-PRP (Pure PRP). Le P-PRP est plus intéressant que le L-PRP pour les propriétés réparatrices recherchées.
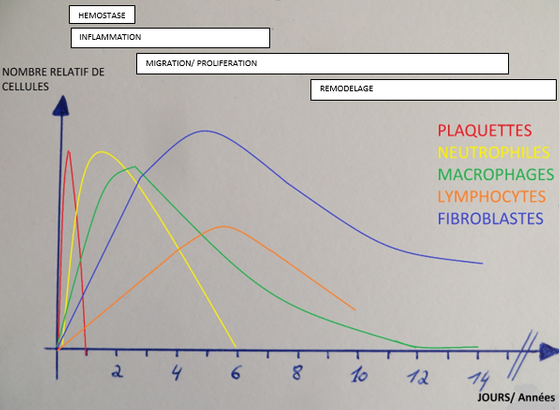
Pour rappel, Le processus de cicatrisation comporte plusieurs étapes. Très rapidement après la lésion d’un tissu entrainant un saignement, l’hémostase (1) a lieu par agrégation plaquettaire et activation de la cascade de coagulation. Ensuite la réaction inflammatoire (2) débute avec sa phase de la vasodilatation, avec l’arrivée des globules blancs qui vont nettoyer la zone et celle de cellules précurseurs qui vont aider à la régénération le tissu lésé. La troisième étape est celle de la migration et prolifération cellulaire (3). Enfin, après quelques semaines, le remodelage (4) du tissu primaire en un tissu fonctionnel peut avoir lieu.
Le PRP reproduit donc les phases d’inflammation, de migration/prolifération et celle de remodelage grâce à l’action des plaquettes, cytokines et facteurs de croissance pour régénérer une structure malade qui spontanément est incapable de se régénérer. Ainsi il permet une meilleure vascularisation, la prolifération et différenciation des cellules en fonction du tissu environnant et une bonne régénération des constituants tissulaires. Certaines études récentes attribuent même au PRP une propriété antalgique. En effet, les plaquettes réduiraient les phénomènes douloureux grâce à un mécanisme encore mal connu via la libération de protéases aux propriétés antalgiques.
4.Processus de centrifugation
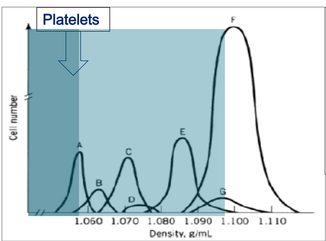
PRP est obtenu en utilisant le processus de centrifugation du sang pour séparer les plaquettes des autres types de cellules. Les globules rouges sont faciles à isoler, car beaucoup plus lourds. Les leucocytes par contre, avec une densité proche de celle des plaquettes le sont beaucoup plus difficilement. La concentration plasmatique en plaquette visée est 2.5 à 3x celle du sang normal.
L’activation des plaquettes (dégranulation) se fait par un processus soit exogène (Chlorure de Calcium, Thrombine et Stress mécanique) soit endogène (contact avec le collagène des tissus lésés). Dans le cas du PRP, elle est exogène par le stress mécanique représenté par la centrifugation.
Il existe à l’heure actuelle plus de 20 dispositifs médicaux sur le marché européen permettant d’obtenir du PRP à usage autologue. Certains d’entre eux s’effectuent avec une seringue contenant déjà un anticoagulant, d’autre nécessitant l’ajout d’anticoagulant dans le tube avant le prélèvement de sang. Certains dispositifs nécessitent l’utilisation d’une centrifugeuse classique, d’autres une centrifugeuse spécifique à chaque firme.
5.Indications en médecine sportive :
A l’heure actuelle, le PRP a démontré son efficacité dans la prise en charge des tendinopathies chroniques, des lésions musculaires et, récemment, son application au niveau du cartilage articulaire est validée.
A. Les tendinopathies chroniques
Le tendon sain a une structure fibrillaire élastique qui part de son enthèse sur l’os et rejoint le muscle via la jonction myotendineuse. Il est constitué de -
•Cellules
-Ténoblastes et Ténocytes au niveau du corps du tendon (qui produisent les fibres de collagène de type 1, de l’élastine ainsi que les composants de la matrice extra-cellulaire-MEC)
-Chondrocytes au niveau de l’enthèse.
-Cellules synoviales au niveau des synoviales du tendon.
•Fibres de collagène de type 1 (70-80% du poids sec du tendon)
•Elastine
•MEC formée d’enzymes, de cytokines, protéoglycanes très hydrophiles et de glycosaminoglycanes.
Les fibres de collagènes sont organisées en fibrilles primaires, elles-mêmes organisées en fibrilles secondaires (fascicules) puis en fibrilles tertiaires.
La vascularisation du tendon provient de la jonction myo-tendineuse, la jonction ostéo-tendineuse et de la membrane synoviale.
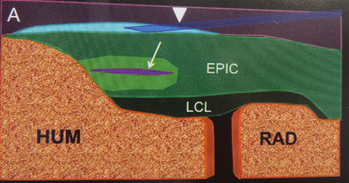
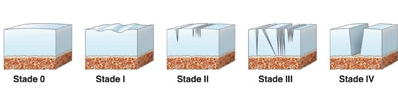
L’étude histologique d’un tendon au stade tendinopathie met en évidence une désorganisation des fibres de collagène, l’apoptose des ténocytes, l’apparition de néo vaisseaux et une augmentation des glycosaminoglycanes inter-fibrillaires. Cette modification résulte soit d’un traumatisme aigu, soit d’une accumulation de stress répétés durant des semaines, mois, années. Dans le cas d’une tendinopathie chronique, le remaniement tissulaire aboutit à dégénérescence lipoïde/mucoïde parfois accompagnée de dépôts calciques.
La difficulté de la prise en charge des tendinopathies résulte du fait que l’activité métabolique des tendons est lente et que la suppléance sanguine est très faible. Sa capacité de guérison et régénération est donc également très lente.
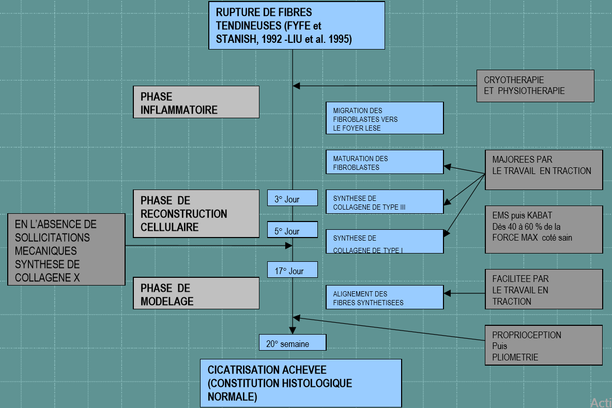
La réparation d’un tendon blessé comprend 3 phases :
1.Initiale : Elle ne dure que quelques jours. Dans les premières 24heures l’arrivée de globules rouges et de facteurs de croissance vasculaires stimule une néo-angiogenèse qui est-elle à l’origine de la prolifération des ténocytes, glycosaminoglycanes et des fibres de collagène.
2.Prolifération cellulaire intensifiée des constituants du tendon, au niveau de l’épi et endotendon, ainsi que des synoviales.
3.Phase de remodelage : la prolifération diminue et on observe l’alignement des fibres de collagène dans le sens du stress.
Il existe plusieurs traitements pour prendre en charge une tendinopathie (le repos, les AINS et les corticoïdes per os ou injectés ont, à l’heure actuelle, perdu leur intérêt dans la prise en charge des tendinopathies) dont :
•La kinésithérapie
•La fascia thérapie
•La thérapie par ondes de chocs
•Le Dry needling
•Le PRP
•La chirurgie
•…
Le PRP a pour but de recréer une réaction inflammatoire aigüe dans la lésion chronique, avec un accent sur la phase proliférative et la synthèse importante de collagène qui l’accompagne. Il permet d’améliorer la différenciation des cellules tendineuses ténocytaires (précurseurs) en ténoblastes (cellules différenciées et actives) et stimule la production de collagène par ces mêmes cellules. -
Le PRP est une alternative validée pour toute tendinopathie chronique, c’est-à-dire qui évolue depuis plus de trois mois…
Les indications du PRP dans les tendinopathies recouvrent donc toute tendinopathie :
Après un échec de 3 à 6 mois de traitement classique (repos, anti-inflammatoires, glace) et après une prise en charge en kinésithérapie (massages, étirements, travail excentrique, traitement par ondes de chocs, ultrasons,…)
Après un échec de traitement classique dans le cadre d’une fissure intra-tendineuse visualisée par une imagerie adaptée (Echographie ou Résonance magnétique)
A distance d’une thérapie au laser, d’une prise en charge chirurgicale ou après des injections de corticoïdes.
A l’heure actuelle, de nombreuses études se sont penchées sur l’efficacité du PRP dans la prise en charge des tendinopathies. Si l’efficacité du PRP sur les tendinoses fissuraires et non-fissuraires du coude, du genou et du pied ne fait plus aucun doute, peu d’études existent sur la prise en charge des autres types de tendinopathies. Les indications de PRP dans les lésions tendineuses sont :
-Les tendons épicondyliens, épitrochléens et rotuliens (75 à 80% des patients traités sont très satisfaits et peuvent retourner à leur niveau sportif pré-symptomatique ; PRP supérieur aux dérivés cortisonés) - -
-Les tendons achilléens (résultats moins spectaculaires consécutifs aux nombreux facteurs dont les facteurs posturaux mais effet positif non chiffré, que ce soit sur les tendinoses fissuraires ou non). -
-L’aponévrosite plantaire (peu d’études, serait bénéfique après 3 mois au niveau douleur et mobilité, efficacité supérieure en cas de fissure) -
-Les tendons de la coiffe des rotateurs (résultats très discordants d’une étude à l’autre, nécessité d’études supplémentaires.)
-Les tendons autour de la hanche : tendinopathie proximale des Ischio-jambiers , trochantérites et adducteurs.
B. Les lésions musculaires
La réparation musculaire est un processus complexe et dynamique qui mène à la remise en continuité de son architecture pour permettre le retour de l’activité contractile. Les facteurs de croissances jouent un rôle important dans le recrutement, duplication, activation et différenciation des précurseurs.
S’il est courant de traiter des lésions musculaires chez les joueurs de football, les études récentes n’ont pas encore réussi à démontrer chez l’homme les mêmes effets que chez l’animal. Cependant, le PRP permet effectivement d’accélérer considérablement le retour sur le terrain. Les médecins et orthopédistes associés aux clubs sportifs traitent donc régulièrement avec du Plasma Riche en Plaquette les lésions musculaires au niveau des Ischio-jambiers et des quadriceps. Le but et d’accélérer le retour sur le terrain et de diminuer les récidives. Le traitement par PRP doit être suivi d’un programme de réhabilitation kinésithérapeutique classique et proche de l’injection.
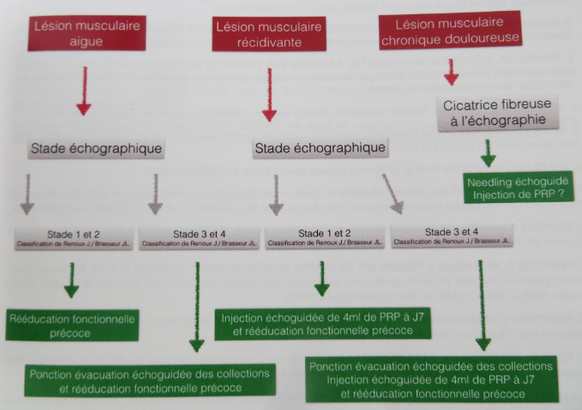
Les indications du PRP dans les lésions musculaires sont - :
1.La lésion musculaire aigue de stade 3 ou 4 avec présence d’un hématome. Dans ce cas l’hématome est ponctionné sous échographie 24h après la lésion et le PRP est injecté dans la cavité devenue virtuelle. Cette indication est principalement d’actualité dans le milieu du foot ou chaque jour d’arrêt engendre des pertes financières importantes. La rééducation fonctionnelle est initiée dès le lendemain de l’injection.
2.La lésion musculaire récidivante de stade 1 et 2 (Injection au jour 7 de PRP sous écho-guidage dans la zone lésée) et de stade 3 et 4 (Ponction évacuatrice suivie d’une Injection de PRP au jour 7 sous écho-guidage) avec rééducation fonctionnelle précoce.
3.La Cicatrice fibreuse. Le thérapeute peut alors sous échographie balayer la zone avec son aiguille en injectant du PRP.
En 2012, Mr Hamid MS est le premier à réaliser une étude randomisée contrôlée couvrant l’évaluation du PRP dans la réparation musculaire. Elle se base sur le nombre de récidives et le délai de reprise de l’activité sportive. Elle compare deux groupes de sportifs ayant des lésions musculaires de grade 2 visualisées à l’échographie (altération de la structure anatomique du muscle, zones hypo échogènes, petits hématomes ou interruption de la structure du muscle). L’un des groupes a été traité par de la kiné traditionnelle, l’autre par une injection de PRP sous échographie suivie par de la physiothérapie. Les résultats démontrent dans le groupe traité par PRP et physiothérapie une diminution plus rapide de la douleur, une amélioration plus importante de la force et de l’amplitude articulaire et un retour sur le terrain plus rapide.
C. Les lésions cartilagineuses
Le cartilage articulaire est un tissu conjonctif non vascularisé et non innervé. Il est nourri par diffusion de nutriments venant de l’os sous chondral et du liquide synovial.
Il est constitué de
-Chondrocytes qui produisent et régulent la MEC
-Matrice Extra Cellulaire : Collagène type 2 (15%), glycosaminoglycanes, eau (70%), électrolytes.
Le cartilage est en équilibre entre les mécanismes de dégradation sous l’influence des cytokines cataboliques et les mécanismes de réparation sous l’effet des cytokines modulatrices et des facteurs de croissance. Malheureusement les chondrocytes articulaires ont un pouvoir mitotique faible et les capacités de réparation du cartilage sont donc faibles. Des microtraumatismes ou une modification liée à l’âge peuvent lui induire de nombreux changements dont l’arthrose. -
Le PRP a une action positive sur les chondrocytes : non seulement les cellules mésenchymateuses multipotentes sont recrutées et stimulées à se différencier en ces cellules du cartilage, mais, en plus, une foi devenues chondrocytes, ces cellules majorent la synthèse de la MEC et de collagène. Le PRP diminuerait également le taux de cytokines inflammatoires cataboliques. -
Des études dont des méta -analyses récentes ont démontré que les injections de PRP sur des lésions cartilagineuses de grade 2et 3 pouvaient réduire douleurs, raideurs articulaires et améliorer la fonction physiologique articulaire. Cet effet serait majoritairement visible à 6 mois (premières améliorations perçues à 2mois, et effet démontré au moins jusque 12 mois post injection). L’efficacité est au moins égale à celle de l’acide hyaluronique injecté (comparaison de groupe de patients traités par PRP versus acide hyaluronique, corticoïdes ou placebo.) - -
Ce sont donc les lésions du cartilage de grade 2et 3 qui répondent bien au PRP. Les lésions de grades 4 malheureusement présentent de larges zones dépourvues de cartilage et le PRP est moins actif sur ces zones. Quoique la majorité des recherches se soit portée sur le traitement de l’arthrose du genou, la pratique du PRP peut se faire également sur l’articulation de la cheville et la hanche. On estime actuellement le bénéfice clinique de l’injection de PRP de 6 mois à 1 an (amélioration de 65 à 70% du score WOMAC chez les patients dans la gonarthrose) mais le renouvellement de l’injection de PRP ne semble pas poser de problème après cette période.
Afin de pouvoir suivre l’évolution du patient après injection de PRP, le thérapeute a à sa disposition des échelles de mesure comme la « WOMAC » (Western Ontario and McMaster Universities Osteoarthritis Index), « KOOS » (Knee injury and Osteoarthritis Outcome Score) ou EVA (Evaluation Visuelle Analogique)
6.Contre-indications
Le traitement par PRP ne se fera pas en même temps que la prise d’AINS, corticoïdes ou aspirine et à distance de toute séance de cryothérapie, ceux-ci ayant un rôle perturbateur de la fonction plaquettaire.
De plus, le traitement par PRP est moins efficace si le patient souffre :
D’une pathologie rhumatismale (arthrite rhumatoïde, arthrite psoriasique,…)
D’une lésion neurologique.
D’un défaut de structure statique ou dynamique du membre ou de l’articulation.
De problèmes de saignements. (Absolue)
D’une hypoplaquettose. (Absolue)
7.En pratique
Avant la prise en charge par PRP, il est important de
•Connaître le passé de la structure anatomique malade
•Réaliser un bilan d’imagerie (Echo, IRM…)
•Réaliser un bilan sanguin pour exclure une hypoplaquettose (taux normal entre 150 000 à 400 000/mm3)
•Expliquer au patient les suites de l’injection.
Le traitement commence par la ponction de 10 à 15ml de sang veineux (veines du bras par ex.) La seringue est ensuite placée dans la centrifugeuse pendant 5mn environ. Une fois le plasma riche en plaquette séparé du reste du sang, il est prélevé dans une deuxième seringue stérile. Le produit est alors injecté dans le tendon, muscle ou articulation malade. L’utilisation d’un appareil échographique pour l’injection est préférable afin d’être au plus près de la zone à traiter. Aucun produit anesthésiant ne sera utilisé, celui-ci altérant la réaction recherchée.
A. Les tendons
Il n’y a pas de consensus établi sur le timing, la quantité et le nombre d’injections. En effet la quantité injectée dépend de la structure à traiter. Cependant la majorité des dernières études ont montré que 2 ou 3 injections étaient en général plus efficaces qu’une seule… Ces injections sont réalisées à 2 semaines d’intervalle pour que le tendon puisse récupérer entre chaque séance. Le PRP est injecté directement dans la fissure s’il y a, ou via une série d’injections qui quadrillent la zone malade. -
Lors de la phase 1 (J0-J3), le thérapeute a pour but de soulager l’éventuelle douleur secondaire à l’injection par la prescription d’un antalgique de palier 1 ou 2, à l’exception des anti-inflammatoires. Il est également demandé au patient d’utiliser le moins possible l’articulation concernée. Certains thérapeutes préconisent même une immobilisation courte (attelle poignet pour les épicondyliens, béquilles pour le tendon d’Achille ou rotulien)
Lors de la phase 2 (J4-14), le patient peut reprendre petit à petit ses activités normales de la vie de tous les jours, sans toutefois appliquer des stress mécaniques sur le tissu. La douleur liée à l’activité doit être à tout prix évitée.
Deux semaines après la dernière injection (phase 3), commence la prise en charge en kinésithérapie. Le patient verra le kinésithérapeute une à deux fois par semaine. Le but est de retrouver l’amplitude articulaire, d’améliorer modérément la force, endurance ainsi que la proprioception. La prise en charge par le physiothérapeute consiste donc en :
•Une mobilisation de l’articulation.
•Le massage transverse profond et travail de fascia.
•Un renforcement musculaire du muscle attenant via des exercices de renforcement isométriques, concentriques et excentriques légers lorsque la structure le permet.
•Exercices de proprioception.
Le but de cette prise en charge est de retrouver l’amplitude articulaire maximale et d’avoir une proprioception identique entre le membre sain et le membre malade. La douleur ne peut apparaître ni dans les mouvements de la vie de tous les jours, ni lors du testing de l’unité musculo-tendineuse. Le médecin reverra le patient à la fin de cette phase 3, c’est-à-dire vers 6-8 semaines post injection.
Enfin, une fois ces critères atteints, la phase 4 peut commencer (en général 6-8 semaines après la procédure (phase 4). Le but de cette phase est de retrouver la force excentrique et concentrique dans les 3 plans de l’espace et d’optimaliser le contrôle neuromusculaire. Les critères de retour sur le terrain doivent être recherchés.
Les thérapeutes pourront évaluer l’efficacité du traitement régulièrement au cours de la prise en charge non seulement via les échanges patient – kinésithérapeute-médecin. Ce dernier reverra le patient lui-même à 2ou 3mois, 6 mois et 1 an. Il aura à sa disposition des outils comme l’imagerie et certaines échelles d’analyse de la douleur. Il existe des échelles de douleur qui sont adaptées à la structure traitée.
•Genou : Victorian Institute of Sports Assessment Patella (VISA-P)
•Général : Visual Analog Scale (VAS))
B.Les lésions musculaires
La prise en charge en kinésithérapie doit être précoce (un ou deux jours) après les injections, qu’elles aient été faites sur les lésions aigües ou chroniques. Elle consiste en une prise en charge classique des lésions musculaires.
C.Les lésions articulaires
La prise en charge d’atteinte du cartilage vise une diminution des douleurs articulaires et vise à retrouver une activité normale à 6 mois. La majorité des thérapeutes rencontrés font également 3 injections à 2 semaines d’intervalle, avec une injection de rappel 1 fois par an si le patient est d’accord. Le patient peut être revu à 3 mois, 6mois et 12 mois. La régénération du cartilage est vu tardivement à l’IRM ou à l’arthro-CT, c’est pourquoi un bilan d’imagerie avant 6-12 mois sera décevant. L’amélioration des symptômes permet d’évaluer le bénéfice du traitement. Elle est suivie grâce aux échelles suivantes :
•EVA (Echelle Visuelle Analogique)
•KOOS (Knee injury and Osteoarthritis Outcome Score)
•WOMAC (Western Ontario and Mcmaster University Osteoarthritis index)
8.Avantages et inconvénients
L’avantage du PRP réside de sa rapidité de fabrication et d’injection. Son caractère autologue n’entraine pas de réaction allergique ni de rejet. Il permet une prise en charge en kinésithérapie très rapide et ne nécessite pas d’immobilisation stricte.
L’inconvénient du PRP peut-être son prix, parfois élevé (pouvant osciller entre 150 et 500 euros). Il est vrai également qu’il manque encore de nombreuses études sur le sujet (par ex. avantage PRP vs Chirurgie) et aucun consensus n’a encore été formellement établi sur une standardisation de la prise en charge.
9.Le PRP et le dopage
Selon l’agence mondiale anti-dopage, WADA, l’usage de préparations dérivées des plaquettes (par exemple « platelet-rich plasma », « blood spinning ») n’est pas interdit s’il est utilisé par voie intra articulaire ou tendineuse. Il reste cependant interdit s’il est injecté dans le système circulatoire. La permission concernant la voie musculaire reste floue. Toutefois, il est nécessaire de déclarer l’usage de PRP conformément au Standard international pour l’AUT.
« In addition, the 2010 List will no longer prohibit supplemental oxygen (hyperoxia). The status of platelet-derived preparations (e.g. Platelet Rich Plasma, “blood spinning”) has also been clarified. These preparations will be prohibited when administered by intramuscular route. Other routes of administration will require a declaration of use in compliance with the International Standard for TUEs. »
Conclusions
La thérapie par Plasma Riche en Plaquette est un procédé relativement récent. Son grand avantage provient de son caractère autologue, ce qui lui permet d’éviter toute forme de rejet ou de réaction allergique. Le coût du traitement parfois élevé reste son principal inconvénient.
Le processus d’extraction et d’injection est relativement simple et peut se faire au cabinet médical. L’échographie est un outil précieux afin d’injecter précisément le PRP dans la zone malade. Elle représente un outil supplémentaire dans la prise en charge des tendinopathies chroniques, des lésions musculaires aigües ou chroniques et du cartilage de grade 2ou 3. Même si la thérapie est récente, les études existantes démontrent déjà une efficacité certaine, certes à court terme vu le manque de recul des follow-up. Il reste donc beaucoup de travail à faire pour documenter cette thérapeutique, mais le PRP a très probablement un bel avenir.
Il est nécessaire d’informer le patient sur le prix, contrôler le nombre de plaquettes et d’exclure les pathologies qui rendent la thérapie moins efficace. Les AINS et corticoïdes sont à éviter. La prise en charge kinésithérapeutique est un des éléments majeurs de la réussite. Le dialogue entre les thérapeutes et le patient est donc très important.
Bibliographie
1. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
2. Arthrex présentation : « Helping surgeons Treat their patients Better »
3. Ferrari M, Zia S, Valbonesi M, Henriquet F, Venere G, Spagnolo S, Grasso MA, Panzani I. A new technique for hemodilution, preparation of autologous platelet-rich plasma and intraoperative blood salvage in cardiac surgery. Int J Artif Organs. 1987 Jan; 10(1):47-50.
4. Robinder S Dhillon1, 2, Edward M Schwarz1, 2 and Michael D Maloney1, 2. Platelet-rich plasma therapy - future or trend? Arthritis Research & Therapy2012
5. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
6. Kaux, Jean-François. Actualités sur l'emploi du PRP dans les tendinopathies. 31ème Séminaire AMDTS de Traumatologie du Sport. mai-2012
7. Kaux, Jean-François. Actualités sur l'emploi du PRP dans les tendinopathies. 31ème Séminaire AMDTS de Traumatologie du Sport. mai-2012
8. Arthrex présentation : « Helping surgeons Treat their patients Better »
9. Huijbregts Peter, Smith Scott. The journal manual and manipulative therapy, vol7, num2, 1999, 71-80
10. Benjamen M, Newell RL, Evans EJ, et AL. The structure of the insertions of the tendons of biceps brachii, triceps and briachialis in elderly dissecting room cadaveres. J Anat. Apr1992 ;180 (Pt2) : 327-332
11. Khan KM, Cook JL, Bonar F, et Al. Histopatology of common tendinopathies. Update and implications for clinical management. Sports Med. Jun 1999 ;27 (6) : 393-408
12. Yu JS, Popp Je, Kaeding CC, et AL. Correlation of MRimaging and pathologic findings in athletes undergoing surgery for chronic patellar tendinitis. AJR Am Roentgenol. Jul 1995 ;165(1) :115-118
13. Murphy PG1, Loitz BJ, Frank CB, Hart DA . Influence of exogenous growth factors on the synthesis and secretion of collagen types I and III by explants of normal and healing rabbit ligaments. Biochem Cell Biol. 1994 Sep-Oct;72(9-10):403-9.
14. Dallaudière B, Lempicki M, Pesquer L, Louedec L, Preux PM, Meyer P, Hess A, Durieux MH, Hummel V, Larbi A, Deschamps L, Benayoun Y, Journe C, Perozziello A, Schouman-Claeys E, Michel JB, Serfaty JM. Acceleration of tendon healing using US guided intratendinous injection of bevacizumab: first pre-clinical study on a murine model. Eur J Radiol. 2013 Dec;82(12):e823-8. doi: 10.1016/j.ejrad.2013.06.012. Epub 2013 Sep 12.
15. Dallaudière B, Lempicki M, Pesquer L, Louedec L, Preux PM, Meyer P, Hummel V, Larbi A, Deschamps L, Journe C, Hess A, Silvestre A, Sargos P, Loriaut P, Boyer P, Schouman-Claeys E, Michel JB, Serfaty JM.
Efficacy of intra-tendinous injection of platelet-rich plasma in treating tendinosis: comprehensive assessment of a rat model. Eur Radiol. 2013 Oct;23(10):2830-7. doi: 10.1007/s00330-013-2926-7. Epub 2013 Jun 26.
16. Leanne Dupley, MRCS1 and Charalambos P. Charalambous, FRCS1,2 Platelet-Rich Plasma Injections as a Treatment for Refractory Patellar Tendinosis: A Meta-Analysis of Randomised Trials. Knee Surg Relat Res. 2017 Sep; 29(3): 165–171. Published online 2017 Sep 1. doi: 10.5792/ksrr.16.055
17. Ronald D. Ford, William P. Schmitt, Kyle Lineberry, and Paul Luce. A retrospective comparison of the management of recalcitrant lateral elbow tendinosis: platelet-rich plasma injections versus surgery. Hand (N Y). 2015 Jun; 10(2): 285–291. Published online 2014 Dec 12. doi:
18. Charousset C1, Zaoui A, Bellaiche L, Bouyer B. Are multiple platelet-rich plasma injections useful for treatment of chronic patellar tendinopathy in athletes? a prospective study. Am J Sports Med. 2014 Apr;42(4):906-11. doi: 10.1177/0363546513519964. Epub 2014 Feb 11.
19. Filardo G, Kon E, Di Matteo B, Di Martino A, Tesei G, Pelotti P, Cenacchi A, Marcacci M. Platelet-rich plasma injections for the treatment of refractory Achilles tendinopathy: results at 4 years. Blood Transfus. 2014 Oct;12(4):533-40. doi: 10.2450/2014.0289-13. Epub 2014 Jun 19.
20. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
21. Vahdatpour B1, Kianimehr L2, Moradi A1, Haghighat S1 Adv Biomed Res. Beneficial effects of platelet-rich plasma on improvement of pain severity and physical disability in patients with plantar fasciitis. A randomized trial. 2016 Nov 28;5:179. doi: 10.4103/2277-9175.192731. eCollection 2016
22. Chiew SK1, Ramasamy TS2, Amini F1Effectiveness and relevant factors of platelet-rich plasma treatment in managing plantar fasciitis: A systematic review. J Res Med Sci. 2016 Jun 14;21:38. eCollection 2016.
23. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
24. Davenport KL, Campos JS, Nguyen J, Saboeiro G, Adler RS, Moley PJ. Ultrasound-Guided Intratendinous Injections With Platelet-Rich Plasma or Autologous Whole Blood for Treatment of Proximal Hamstring Tendinopathy: A Double-Blind Randomized Controlled Trial. J Ultrasound Med. 2015 Aug;34(8):1455-63. doi: 10.7863/ultra.34.8.1455.
25. Dallaudière B1, Pesquer L2, Meyer P2, Silvestre A2, Perozziello A3, Peuchant A2, Durieux MH2, Loriaut P4, Hummel V5, Boyer P4, Schouman-Claeys E6, Serfaty JM7. Intratendinous injection of platelet-rich plasma under US guidance to treat tendinopathy: a long-term pilot study. J Vasc Interv Radiol. 2014 May;25(5):717-23. doi: 10.1016/j.jvir.2014.01.026. Epub 2014 Mar 20.
26. Reurink G, Verhaar JA, Tol JL More on platelet-rich plasma injections in acute muscle injury. N Engl J Med. 2014 Sep 25;371(13):1264-5. doi: 10.1056/NEJMc1409204.
27. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
28. Renou J, Mercy G, Zeitoun-Eiss D , Brasseur JL. Valeur pronostique de l’échographie dans les lésionsmusculaires post-traumatiques.
Brasseur JL, Zeitoun-Eiss D, Bach G, Renoux J, Grenier P. Actualités en échographie de l’appareil locomoteur (TOME 8) SAURAMPS MEDICAL ; Montpellier 2011
29. A Hamid MS, Mohamed Ali MR, Yusof A, George J, Lee LP. Platelet-rich plasma injections for the treatment of hamstring injuries: a randomized controlled trial. Am J Sports Med. 2014 Oct;42(10):2410-8. doi: 10.1177/0363546514541540. Epub 2014 Jul 29. Erratum in: Am J Sports Med. 2015 May;43(5):NP13.
30. Moyer RF1, Ratneswaran A2, Beier F2, Birmingham TB3. Osteoarthritis year in review 2014: mechanics-basic and clinical studies in osteoarthritis. 2014 Dec;22(12):1989-2002. doi:0.1016/j.joca.2014.06.034. Epub 2014 Nov 22.
31. Fernandes JC, Martel-Pelletier J, Pelletier JP. The role of cytokines in osteoarthritis pathophysiology. Biorheology. 2002;39(1-2):237-46. Review.
32. Hildner F1,2, Eder MJ1,2, Hofer K1,2, Aberl J1,2, Redl H3,2, van Griensven M3,2, Gabriel C1,2, Peterbauer-Scherb A1,2. Human platelet lysate successfully promotes proliferation and subsequent chondrogenic differentiation of adipose-derived stem cells: a comparison with articular chondrocytes. J Tissue Eng Regen Med. 2015 Jul;9(7):808-18. doi: 10.1002/term.1649. Epub 2013 Jan 9.
33. Krüger JP1, Hondke S, Endres M, Pruss A, Siclari A, Kaps C. Human platelet-rich plasma stimulates migration and chondrogenic differentiation of human subchondral progenitor cells. J Orthop Res. 2012 Jun;30(6):845-52. doi: 10.1002/jor.22005. Epub 2011 Nov 4.
34. Betsch M, Schneppendahl J, Thuns S, Herten M, Sager M, Jungbluth P, Hakimi M, Wild M.
PLoS One. Bone marrow aspiration concentrate and platelet rich plasma for osteochondral repair in a porcine osteochondral defect model. 2013 Aug 12;8(8):e71602. doi: 10.1371/journal.pone.0071602. eCollection 2013.
35. Wen-Li Dai M.Sc. Ai-Guo Zhou M.D. Hua Zhang M.D.Jian Zhang M.D. Efficacy of Platelet-Rich Plasma in the Treatment of Knee Osteoarthritis: A Meta-analysis of Randomized ControlledTrials. Arthroscopy: The Journal of Arthroscopic & Related Surgery. Volume 33, Issue 3, March 2017, Pages 659-670.e1
36. Carlos J.MeheuxM.D.Patrick C.McCullochM.D.David M.LintnerM.D.Kevin E.VarnerM.D.Joshua D.HarrisM.D. Efficacy of Intra-articular Platelet-Rich Plasma Injections in Knee Osteoarthritis: A Systematic Review. Arthroscopy: The Journal of Arthroscopic & Related Surgery. Volume 32, Issue 3, March 2016, Pages 495-505
37. Patrick A. Smith, MD* Intra-articular Autologous Conditioned Plasma Injections Provide Safe and Efficacious Treatment for Knee Osteoarthritis. An FDA-Sanctioned, Randomized, Double-blind, Placebo-controlled Clinical Trial. AJSM PreVieuw, Published February 1, 2016
38. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
39. Carofino B1, Chowaniec DM, McCarthy MB, Bradley JP, Delaronde S, Beitzel K, Cote MP, Arciero RA, Mazzocca AD. Corticosteroids and local anesthetics decrease positive effects of platelet-rich plasma: an in vitro study on human tendon cells. Arthroscopy. 2012 May;28(5):711-9. doi: 10.1016/j.arthro.2011.09.013. Epub 2012 Jan 21.
40. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
41. Ken Krogman, MSPT, ATC, Marc Shery, PT, DPT LAT, CSCS, DR John Wilson and the Uw Sports Medecine physician group. Platelet-Rich Plasma Rehabilitation Guidelines. 4/2014
42. B.Dallaidière, A.Silvestre. Plasma enrichi en plaquettes en pathologie musculosquelettique. SAURAMPS MEDICAL. Oct2016
43. Robinder S Dhillon1, 2, Edward M Schwarz1, 2 and Michael D Maloney1, 2. Platelet-rich plasma therapy - future or trend? Arthritis Research & Therapy2012
44. https://www.wada-ama.org/en/adams
Dr Cédric DANNIAU
Médecine du sport
(Fr - Nl - Eng - Esp)
Mardi AM
Jeudi PM
0488/484.308
cdanniau@live.be
Dr Hervé AUQUIER
Médecine du sport
(Fr - Eng)
Lundi AM & PM
Mercredi AM & PM
0475/589.584
auquier.herve@hotmail.com